知財判例データベース COVID-19遺伝子ワクチン用DNA断片に関する発明の進歩性が先行発明の結合により否定された事例
基本情報
- 区分
- 特許
- 判断主体
- 特許法院
- 当事者
- 原告A株式会社 vs 被告特許庁長
- 事件番号
- 2022ホ2530拒絶決定(特)
- 言い渡し日
- 2023年04月27日
- 事件の経過
- 判決確定
概要
出願発明は、COVID-19遺伝子ワクチン用DNA断片に関する発明であって、SARS-CoV-2(サーズコロナウイルス-2)の遺伝子配列においてアミノ酸配列のうち一部のアミノ酸の置換を含むことを特徴とする。特許法院は、出願発明のDNA断片がコーディングするCOVID-19抗原用タンパク質のうち、先行発明1に開示されていない8つのアミノ酸残基を置換する構成について、先行発明1に引用された参考文献、先行発明2もしくは3に開示されているか、または、タンパク質の主要切断部位に該当して該当部位における置換を試みることができ、その置換の候補としてアラニンやグリシンへの置換も容易に考慮できる点を挙げ、先行発明の結合から出願発明の構成に容易に至ることができると判断した。さらに、原告が提示した比較実験結果は出願発明と先行発明の効果を対比するのに不十分であるため、出願発明の効果の顕著性も認められないことを理由として出願発明の進歩性を否定した。
事実関係
原告は「COVID-19抗原用タンパク質、これをコードするDNA断片及びこれを含む遺伝子ワクチン」を発明の名称とする発明に関して、2020年11月12日付で特許出願をした。被告である特許庁は、2021年11月18日付で、出願発明が先行発明1~3の結合により進歩性が欠如することを理由として拒絶決定をした。原告は拒絶決定不服審判を請求したが、特許審判院は2022年2月24日付で原告の審判請求を棄却する審決をした。これに対して原告は、特許法院に審決取消訴訟を提起した。
出願発明は審査過程で2回補正されており、代表請求項として最終的に補正された請求項2は下記の通りである。
請求項2
配列番号4の遺伝子配列からなり、COVID-19抗原用タンパク質をコードするCOVID-19遺伝子ワクチン用DNA断片であって、上記COVID-19抗原用タンパク質はY449A、N487A、Q493A、N501G、Y505G、R683G、R685G、R815G、K986P及びV987Pに置換され、
上記遺伝子配列はCMVプロモーター、Kozak配列、IgMsignalペプチド配列、標的抗原、BGHpoly(A)tail及び連続的な2つのSV40エンハンサーの順序で配列された組換えベクターに標的抗原として含まれ、
上記組換えベクターはCOVID-19遺伝子ワクチン用組成物に含まれることを特徴とする、COVID-19遺伝子ワクチン用DNA断片。
先行発明1は2020年8月14日付で公表された、題目を「ヒマラヤサルにおけるSARS-CoV-2に対するDNAワクチン保護」とする論文であり、先行発明2は2020年8月7日付でオンライン公開された、題目を「変異が宿主細胞受容体ACE2を有するヒトSARS-CoV-2の受容体結合ドメイン構造、機能、疫学に及ぼす影響」とする論文であり、先行発明3は2020年3月30日付でオンライン公開された、題目を「SARS-CoV-2による受容体認識の構造的基盤」とする論文である。
原告は、下記の内容を理由として、請求項2の発明は先行発明の結合により進歩性が否定されないと主張した。- 請求項2の発明における「COVID-19抗原用タンパク質がY449A、N487A、Q493A、N501G、Y505G、R683G、R685G、R815G、K986P、V987Pに置換」される構成は、先行発明1、2、3に提示または暗示されていない。すなわち、スパイクタンパク質の①受容体-結合領域(Receptor-BindingDomain; RBD)において493位グルタミン(Q)をアラニン(A)に、501、505位のアスパラギン(N)、チロシン(Y)をグリシン(G)に置換する構成、②S1/S2フーリン(furin)切断部位において683、685位のみ選択し、アルギニン(R)をグリシン(G)に置換する構成、③S2’切断部位である815位の残基を置換する構成に関する記載や暗示がない。
- 請求項2の発明において「(上記遺伝子配列は)CMVプロモーター、Kozak配列、IgMsignalペプチド配列、標的抗原、BGHpoly(A)tail及び連続2つのSV40エンハンサーの順序で配列された組換えベクターに標的抗原として含まれ、上記組換えベクターはCOVID-19遺伝子ワクチン用組成物に含まれることを特徴とする」部分(以下「組換えベクター部分」という)は、請求項2の発明の技術的構成要素に該当する。このような構成は、先行発明1、2、3に提示または暗示されておらず、原告特許第2216078号(以下「原告関連特許」という)として登録されて既に進歩性が認められている。
- 請求項2の発明は、通常の技術者が先行発明1、2、3を結合して容易に考え出すことができず、先行発明から予測できない顕著な効果を奏する。
判決内容
特許法院は、関連法理として下記の内容を提示した。
「複数の先行技術文献を引用して特許発明の進歩性を判断するときは、引用される技術を組合せまたは結合すれば、その特許発明に至ることができる暗示、動機等が先行技術文献に提示されているか、そうでなくても特許発明の出願当時の技術水準、技術常識、その技術分野の基本的課題、発展傾向、業界の要求等に鑑みて通常の技術者が容易にそうした結合に至ることができると認めることができれば、当該特許発明の進歩性が否定される(大法院2007年9月6日付言渡2005フ3284判決参照)。」
特許法院は、まず、請求項2の発明の組換えベクター部分は請求項2の発明の技術的構成要素であるということはできないと判断した。具体的には、請求項2の発明が保護を受けようとする事項は「DNA断片」であり、運搬体であるベクターはそこに挿入して運搬しようとする遺伝物質(遺伝子ワクチン用抗原遺伝子等)とは区別されるところ、請求項2の発明の組換えベクター部分は、原告関連特許のベクターにおいて「炭疽菌D4抗原」の代わりに「配列番号4の遺伝子配列」を挿入した点が相違するのみである点、組換えベクター部分は、請求項2の発明により保護を受けようとする「DNA断片」をいかなる方法で遺伝子ワクチンとして使うかについての用法を記載したものに過ぎず、請求項2の発明の対象である「DNA断片」自体を限定する技術的構成要素であるということはできない点をその判断の根拠として挙げた。これにより、請求項2の発明の請求の範囲は、「配列番号4の遺伝子配列からなる、Y449A、N487A、Q493A、N501G、Y505G、R683G、R685G、R815G、K986P及びV987Pに置換された(COVID-19抗原用タンパク質をコードするCOVID-19遺伝子ワクチン用)DNA断片」と解釈することが妥当であると判断した。
続いて、特許法院は、請求項2の発明はSARS-CoV-2(COVID-19)スパイクタンパク質アミノ酸置換を通じて抗原用タンパク質をコードする遺伝子ワクチン用DNA断片を提供することに目的がある発明であり、先行発明1はSARS-CoV-2スパイクタンパク質の6種類の変異体であるプロトタイプDNAワクチン候補群を開発し、ヒマラヤサルに対する攻撃後の防御試験(challenge)を通じてその候補の免疫原性と保護効能を評価するための論文として、その技術分野と発明の目的が共通し、SARS-CoV-2の遺伝子配列は2020年2月頃に公開され、全世界の科学者がその直後からこれに基づいて多くの研究結果を出し始めたことは多数の者が広く知る事実であるとし、請求項2の発明と先行発明1の差異点を下記の通り判断した。
| 構成要素 | 請求項2の発明 | 先行発明1 | 対比 |
|---|---|---|---|
| 1 | 配列番号4の遺伝子配列からなる、(COVID-19抗原用タンパク質をコードするCOVID-19遺伝子ワクチン用)のDNA断片 | SARS-CoV-2スパイクタンパク質の変異体6種類(図面1.A)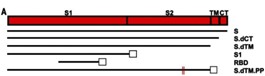 |
同一 |
| 2 | Y449A、N487A、Q493A、N501G、Y505Gに置換 | 開示なし(先行発明2にY449A、N487A、N501A、Y505Aに置換する構成、先行発明3にQ493N、Q493Y、N501Tに置換する構成が開示されている) | 差異点1 |
| R683G、R685Gに置換 | 先行発明1の変異体S.dTM.PPはフーリン切断部位を削除した点、先行発明1に引用された参考文献13に682、684位まで置換して683、685位のアルギニン(R)をセリン(S)に置換することが開示されている | 差異点2 | |
| R815Gに置換 | 開示なし | 差異点3 | |
| K986P、V987Pに置換 | 残基986、987のプロリン(P)置換が開示されている | 同一 |
特許法院は、差異点1~3が下記のように通常の技術者が先行発明の結合により容易に導き出し得ると判断した。
- 差異点1(Y449A、N487A、Q493A、N501G、Y505Gへの置換)
先行発明2及び3は、スパイクタンパク質により媒介されるウイルス進入段階において、ACE2(Angiotensin-Converting Enzyme2; 呼吸器等の上皮細胞に存在する酵素受容体で、SARS-CoV-2が宿主細胞の表面に付きやすいようにしてウイルスの細胞浸透能力を高める)と結合する部分である受容体-結合モチーフ(Receptor-Binding Motif;RBM)残基の変異がACE2の結合力を下げ得ることを示している。先行発明2には、RBMの一部をY449A、N487A、Y489A、N501A、Y505Aに置換する構成がACE2の結合強度を撹乱する点、493位が受容体結合に関与する点が開示されている。先行発明3には、Q493N、Q493Y、N501Tへの変異がACE2の結合親和度を下げることが開示されている。差異点1のうちY449A、N487Aは、先行発明2に完全に開示されている。残りのQ493A、N501G、Y505Gに関連し、先行発明2、3においては493位のグルタミン(Q)がアスパラギン(N)、チロシン(Y)に、501、505位のアスパラギン(N)、チロシン(Y)がアラニン(A)、トレオニン(T)に各々置換・変異された点が相違するが、請求項2の発明が採択したグリシン(G)、アラニン(A)はアミノ酸のうち構造が最も簡単な非極性アミノ酸に該当し、通常の技術者が第一に容易に考慮し得る選択肢に属する。出願発明の原出願日以前に、特定位置のアミノ酸に突然変異を誘発してアラニンに置換する方法であるアラニンスキャニングが、上記発明の属する微生物学、分子生物学等の技術分野において広く行われていた。SARS-CoV-2受容体と密接に相互作用するRBMの位置が449、487、493、501、505番であると知られている以上、通常の技術者であれば、当該位置の残基から置換しようと試みるはずであり、アラニン(A)またはグリシン(G)への置換をまず考慮するはずである。したがって、差異点1は、通常の技術者の一般的な創作能力の範囲内において技術的困難性がない。
- 差異点2(R683G、R685Gへの置換)
先行発明1には、S.dTM.PP(フーリン切断部位の削除、2つのプロリン置換、フォルドン三量体タグをした、融合前の安定化した可溶性細胞外ドメイン)の場合、フーリン切断部位の突然変異によって分泌タンパク質の加水分解切断(proteolytic cleavage)が起こらないと推定されるという記載があり、ワクチンが効果的に機能するためには、そのような安定化が重要である旨の記載がある。先行発明1に引用された参考文献13には、フーリン切断部位中の682~685位のアミノ酸残基をアミノ酸GSASに置換する構成等が開示されている。すなわち、原告が試みた683、685位の置換が開示されている。原告は「フーリン切断部位の683、685位が抗原の安定性確保に最も重要であると判断したため2カ所のみ置換し、先行発明1等には特定位置が他の位置よりも重要であるとの記載や暗示がない」と主張しているが、出願発明の明細書には当該内容がなく、そのような効果も確認されていない。だとすれば、残基置換の候補として知られている位置のうち一部のみグリシン(G)に置換することは、通常の技術者が具体的な開示や暗示がなくとも容易に試みることができる範囲内にある。 - 差異点3(R815Gへの置換)
出願発明の原出願日前である2020年6月2日付でオンライン公開された論文(乙第5号証)の図面3.A.B.[図5]も、S2’の切断部位の位置を下記の通り示している。
出願発明の出願日前に頒布された種々の文献には、SARS-CoV-2が細胞内に浸透するとき「S 2’(R815位置)切断」はS1/S2切断があった後に生じると認められ、原形質膜において宿主-受容体結合が起こるか、またはウイルスの細胞内移入(endocytosis)があるまでは起こらないことがある点が開示されていた。S2’切断に関与するTMPRSS2(transmembrane serine protease2)抑制剤とS1/S2切断に関与するフーリン抑制剤MI-1851を結合すれば、SARS-CoV-2に対してさらに強力な抗ウィルス活性が生じることも知られていた。したがって、通常の技術者はS1/S2フーリン切断部位と共にS2’切断部位の置換を試みるはずで、グリシン(G)への置換は通常の技術者の一般的な創作能力の範囲内にあるもので技術的困難性がない。
- 原告は「請求項2の発明は、野生型Sタンパク質より抗体価が約10倍高く示され、1:2560の希釈倍率まで中和能を示し、1:40の希釈倍率まで95~100%の細胞生存率を示した」という比較実験結果を提示しながら、「請求項2の発明の抗体価が先行発明1より500倍高い」と主張する。しかし、原告が比較実験において対照群とした野生型タンパク質(wtCoV)のアミノ酸配列を見れば、986、987位のアミノ酸はそれぞれリシン(K)とバリン(V)である。先行発明1に引用された参考文献13には、986、987位のアミノ酸をプロリン(P)に置換するのに加えてフーリン切断部位を置換した構成が開示されており、複数の先行技術文献にこのような安定化が中和抗体の形成を高める点が開示されている。原告が請求項2の発明の顕著な効果を示すためには、プロリン置換等の先行発明に開示された部分については同条件として対照した実験結果を提示すべきである。
- 請求項2の発明はゴールデンハムスターを対象として実験し、先行発明1の実験はヒマラヤサルに対するものとして種差が存在し、請求項2の発明の実験と先行発明1の実験は組換えベクターの構成に差があるため、条件が同じではない。
専門家からのアドバイス
本件は、COVID-19遺伝子ワクチン用DNA断片に関する発明の進歩性を争ったもので、当該DNA断片がコーディングするCOVID-19抗原用タンパク質において特定アミノ酸部位が置換されたことを特徴とする発明に対して、先行発明1~3の結合により進歩性が否定されている。
これについて特許法院は、本件のタンパク質のアミノ酸置換体においてアミノ酸配列中の置換位置が先行発明にある程度開示または暗示されている点、および、その置換アミノ酸(アラニンまたはグリシン)も当業界の技術分野において優先的に考慮され得る点等に基づいて、発明の進歩性を否定したのであるが、こうした本件の特許法院の判断は、タンパク質のアミノ酸置換体に関する発明の具体的な進歩性判断を示した事例として実務上参考になる。
ジェトロ・ソウル事務所知的財産チーム
ジェトロ・ソウル事務所 知的財産チームは、韓国の知的財産に関する各種研究、情報の収集・分析・提供、関係者に対する助言や相談、広報啓発活動、取り締まりの支援などを行っています。各種問い合わせ、相談、訪問をご希望の方はご連絡ください。
担当者:大塚、李(イ)、半田(いずれも日本語可)
E-mail:kos-jetroipr@jetro.go.jp
Tel :+82-2-3210-0195




 閉じる
閉じる