知財判例データベース 特許庁の旧告示に基づき存続期間延長の無効が争われ、外国の臨床試験期間が存続期間の延長期間に含まれるとされた事例
基本情報
- 区分
- 特許
- 判断主体
- 特許法院
- 当事者
- 原告A社 vs 被告B社(審判請求人)
- 事件番号
- 2019ホ3595存続期間延長無効(特)
- 言い渡し日
- 2020年10月29日
- 事件の経過
- 審決取消し(現在上告審進行中)
概要
現在適用されている、医薬品許可等に基づいた存続期間の延長期間算定に関する特許庁の現告示によると、延長対象期間には国内の臨床試験期間のみが含まれる。一方、2000年の特許庁の告示(旧告知)では、延長対象期間を国内の臨床試験計画書の承認日から品目許可日までの期間として現告示よりも広範囲で認めるとともに、国内の臨床試験がなされていない場合、外国における第3相臨床試験期間も延長対象期間として認めていた。本件の対象特許発明については特許庁の旧告示により存続期間延長がされたところ、被告(請求人)は一部の延長された期間が特許権者等の帰責事由により要された期間であるため無効とされるべきであることを理由として無効審判を請求し、特許審判院はこれを認容する審決をした。原告(被請求人)は審決取消訴訟を提起し、外国の臨床試験期間は延長期間として認められるべきであると主張したのに対し、特許法院は原告の主張を受け入れて審決を取り消した。
事実関係
原告は、発明の名称を「N-置換された2-シアノピロリジン」とする出願をし、2005年8月11日付で登録を受けた。上記特許発明の通常実施権者であるG株式会社(以下「G」と言う)は、ビルダグリプチンを原料医薬品として第2型糖尿病の治療用途を有する医薬品であるガルバス錠50ミリグラムについて医薬品輸入品目許可申請をし、2007年12月28日付で食品医薬品安全庁長(現食品医薬品安全処長)から品目許可を受けた。Gは、上記特許発明の特許権設定登録日である2005年8月11日から輸入品目許可日である2007年12月28日までの2年4月18日のうち、食品医薬品安全庁(以下「食薬庁」と言う)の要請による資料補完期間54日を除いた2年2月23日について延長登録出願をし、延長登録を受けた(当時適用されていた2000年の特許庁の告示は、食品医薬品安全庁長から臨床試験計画書の承認を受けた日又は特許権設定登録日のうち遅い日から医薬品許可を受けた日までの期間を延長期間として認め、特許法によりこのうち特許権者等の帰責事由により要された期間が除外された)。
被告は、上記延長期間のうち187日が延長期間に含まれてはならない期間であることを理由として無効審判を請求し、特許審判院は、上記187日の期間1(132日)と期間2(55日)(注1)について特許権者に責任がある事由により要された期間に該当するため、無効とされるべきであると判断した。期間1は下表に示した通り、国内の臨床試験終了の翌日である2006年1月7日から原料医薬品申告書(DMF)提出日の前日である2006年5月18日までの132日である。
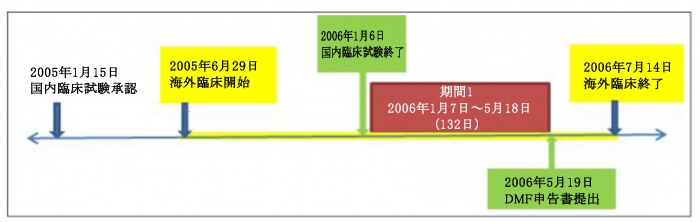
上記特許審判院の審決について、原告は審決取消訴訟を提起したが、期間1が特許権者である原告に責任がある事由により要された期間であると言うことができないとの原告の主張は下記の通りであった。
(1)審決は、期間1において外国の臨床試験が進行中であったにもかかわらず、国内の臨床試験終了により臨床試験が終了したものと誤って把握した。外国の臨床試験は許可のために必要な試験であるため、この臨床期間を存続期間の延長期間から除外する法的根拠はない。
(2)臨床試験と品目許可審査はDMFの審査と相関関係がなく、関連法規はDMF提出時期について許可申請人に注意義務を課していない。
(3)DMF手続と安全性及び有効性審査手続(以下「安全性・有効性審査手続」と言う)は互いに独立した手続であり、期間1以前にDMF申告書を提出したとしても許可日が前倒しにならなかったはずであるため、DMF申告書の提出時期と許可遅延との間に相当な因果関係が認められない。
これに対して被告は下記の通り主張した。
(1)国内の臨床試験終了からDMF申告日までの期間1は、許可権者が正当な理由なく特許発明の実施のための許可や登録を申請していない帰責期間に該当するため、延長期間から除外されるべきである。
(2)期間1において進行された外国の臨床試験は、2000年の特許庁の告示によると、本件延長期間に含まれない。外国の当該臨床試験は、品目許可のために必ず提出しなければならない臨床試験、または食薬庁において提出するよう命じた臨床試験でもなく、許可権者が恣意的に提出した資料に過ぎないため、延長期間に含まれない。
判決内容
特許法院は、期間1が特許権者である原告に責任がある事由により要された期間と言えないと判断した。特許法院が提示した関連法理は次の通りであった。
旧特許法第89条第1項は「特許発明を実施するために他の法令の規定により許可を受け、又は登録等をしなければならず、その許可又は登録等(以下「許可等」と言う)のために必要な活性・安全性等の試験により長期間を要する大統領令で定める発明である場合には、第88条第1項の規定にかかわらず、その実施することができなかった期間について5年の期間内において当該特許権の存続期間を延長することができる」と規定し、第89条第2項は「第1項を適用するにおいて、特許権者に責任がある事由により要された期間は、第1項の『実施することができなかった期間』に含まれない」と規定しているが、ここにおいて「責任がある事由により要された期間」とは、特許権者等の帰責事由により薬事法等の許可等が実際に遅れた期間、即ち特許権者等の帰責事由と薬事法等による許可等の遅延との間に相当な因果関係が認められる期間を意味する(特許法院2017年3月16日言渡2016ホ4498、4504、4511、5620判決等参照)。
特許法院は、上記法理を適用して、期間1が特許権者等の帰責事由により許可等が遅れた期間とは言えないと判断した。具体的には、i)薬事法及び施行規則にはDMF申告書を添付して提出するように規定しているだけで、許可権者がDMF申告書を国内の臨床試験終了日以前に提出しなければならない規定はない点、ii)製薬業界においては、通常、臨床試験が終了した後に品目許可申請と同時に又はその頃にDMF申告書を提出する場合が多い点から、製薬業界の実務に鑑み、本件において社会通念上、一般的に要求される程度の注意義務を怠ってDMF申告書の提出が遅れたとも言い難いと判断した。また、DMFの審査手続と安全性・有効性審査手続は互いに独立的な手続であるため、DMFの審査手続を期間1の以前に繰り上げたとしても安全性・有効性審査手続が前倒しされると言うことはできないため、期間1の以前にDMF申告書を提出したとしても本件許可が早まると言うことができない点から、DMF申告書の提出時期と許可遅延との間に相当な因果関係を認め難いと判断した。
さらに、期間1の間に行われた外国の臨床試験の期間は、特許発明を実施することができなかった期間に該当すると判断した。具体的には、旧特許法及び旧薬事法等には「許可等のために必要な活性・安全性等の試験」から外国の臨床試験が除外されると言うに値する根拠がなく、外国の臨床試験が国内の品目許可を受けるのにおいて必要な臨床試験であるのであれば、外国の臨床試験期間は発明を実施することができなかった期間に該当すると言うのが妥当であると判断したが、その主要根拠は次の通りであった。
1.旧特許法第89条は「許可等のために必要な活性・安全性等の試験」と規定しており、旧薬事法は許可を受けるために「安全性・有効性に関する試験成績書」を提出するようにしているだけで、このための臨床試験が国内において実施されることを限定してはいない。旧薬事法施行規則による「医薬品等の安全性・有効性審査に関する規定」は、「外国」において試験した資料であっても「許可国の政府(許可又は登録機関)が提出を受けるか又は承認したことを確認したもの又はこれを公証した資料」であれば適法な許可資料として認めている。したがって、旧特許法第89条の「許可等のために必要な活性・安全性等の試験」には外国の臨床試験も含まれると言うのが妥当であり、これとは異なって国内の臨床試験と外国の臨床試験とを差別する合理的な理由を見出し難い。
2.外国の臨床試験結果は、本件2次品目許可申請当時に提出された資料であって、食薬庁作成の「安全性・有効性審査結果書」に外国の臨床試験資料として記載されており、本件許可事項にも外国の当該臨床試験における臨床試験結果が検討された内容が具体的に記載されている。このような事情に鑑みると、外国の当該臨床試験結果は、本件許可においてビルダグリプチンの「安全性及び有効性」に関する資料として検討されたため、本件品目許可を受けるために必要な資料であると言うのが妥当である。
3.被告は、2000年の特許庁の告示によると、外国の臨床試験期間は特許発明を実施することができなかった期間に含まれないため、期間1は存続期間の延長から除外されるべきであると主張する。これについて詳察したところ、先に詳察した通り、品目許可手続において検討され反映された外国の臨床試験が特許発明を実施することができなかった期間から除外されると言うに値する法的根拠がない。2000年の特許庁の告示は、延長され得る期間を「臨床試験計画書の承認を受けた日又は特許権の設定登録日のうち遅い日から医薬品許可を受けた日までの期間」と規定しつつ、そのただし書においては「国内の臨床試験の実施が免除された場合」は「外国における第3相臨床試験所要期間と医薬品許可を受けるために関連書類を受理した日から医薬品製造許可を受けた日までの期間とを合算した期間」として規定している。このように2000年の特許庁の告示によっても国内において臨床試験が実施された本件の場合、臨床試験計画書の承認日又は特許権の登録日のうち遅い日から医薬品許可日までの全期間を延長期間として規定しており、外国の臨床試験期間が除外されると言うに値する記載はない。
専門家からのアドバイス
韓国において、医薬品許可等による存続期間の延長登録に関連した特許法第89条による延長期間の算定方法を特許庁の告示で規定している。現在適用されているのは2005年以後の特許庁の告示であって、国内の臨床試験期間と食薬処の許可申請関連書類の検討期間とを合算した期間を延長期間としており、その文言上においては外国における臨床試験期間が延長期間として認められないものとされている。一方、2000年の特許庁の告示では、外国において開発された新薬であって国内の臨床試験が免除されている場合、外国における第3相臨床試験期間と食薬庁の許可書類の検討期間とが延長期間として認められると規定しており、その文言上において外国における臨床試験期間も延長期間として認めることを許容するものであった。
このうち本件は2000年の特許庁の告示が適用される事例であって、国内の臨床試験が進行されたことにより国内の臨床試験計画の承認日から品目許可日までの期間が延長期間として認められるものであるが、2000年の特許庁の告示によっても外国の臨床試験期間は考慮されないと判断される余地もあった。しかし、特許法院は、特許法第89条の「許可等のために必要な活性・安全性等の試験」について、国内の品目許可を受けるのに必要な臨床試験であれば外国の臨床試験も含まれ、外国の臨床試験と国内の臨床試験を差別する合理的理由がないとの判断を下した。
本事例は、特許庁の旧告示に関連したものであったが、特許庁の現告示による外国の臨床試験期間の扱いはどのようになるであろうか。本件での特許法院の判示内容を考慮してみれば、特許庁の現告示の下で、外国の臨床試験期間がいかなる場合にも延長期間として認められないとすることに対しては問題提起があり得るものと予想される。なお、本件については現在大法院で上告審が進行中であるため大法院での判断を待つ必要があるとともに、今後の法院での関連判決の推移等についても見守る必要があろう。
注記
-
期間2は、安全性・有効性審査手続における申請人の審査書類の不備からの帰責事由により延長期間から除外されるべきと被告が主張した期間に相当し、外国の臨床試験期間に関連したものではない。
ジェトロ・ソウル事務所知的財産チーム
ジェトロ・ソウル事務所 知的財産チームは、韓国の知的財産に関する各種研究、情報の収集・分析・提供、関係者に対する助言や相談、広報啓発活動、取り締まりの支援などを行っています。各種問い合わせ、相談、訪問をご希望の方はご連絡ください。
担当者:大塚、柳(ユ)、李(イ)、半田
E-mail:kos-jetroipr@jetro.go.jp
Tel :+82-2-3210-0195




 閉じる
閉じる