医療機器の現地輸入規則および留意点:中国向け輸出
質問
中国向けに医療機器を輸出する際の現地輸入規則と留意点について教えてください。
回答
Ⅰ. 医療機器の定義
「医療機器監督管理条例」(以下、「条例」)では「医療機器」を定義しています。この主旨は国際的な定義、ISO13485の定義とほぼ同じです。
Ⅱ. 医療機器の分類
中国で⽣産、販売(取扱い)および使⽤される医療機器は、上記「条例」により、その安全性や有効性に対する管理の程度によって、次の3種類に分類されます。
医療機器の分類や登録・届出は、製品の種類やリスクに応じて、国家薬品監督管理局(NMPA)または製造者・申請者の所在地を管轄する省級薬品監督管理部門に申請されなければならず(第I類は届出、第II類・第III類は登録)、これらの手続きを経ずに医療機器を生産・販売・使用することはできません。
第I類:低リスク、通常の管理によって、その安全性、有効性を保証できる医療機器
第II類:中リスク、その安全性、有効性を保証するためには厳格な管理が必要とされる医療機器
第III類:高リスク、その安全性、有効性を保証するために特別な措置を通じて厳格な管理が必要とされる医療機器
-
医療機器目録(2017年8月)
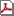 (3.5MB)
(3.5MB)
-
医療機器目録(2020年12月内容調整意見総括表)
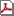 (322KB)
(322KB)
-
医療機器目録(2022年3月24日付公告による一部調整)
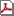 (211KB)
(211KB)
-
医療機器目録(2022年3月30日付公告による一部調整)
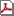 (461KB)
(461KB)
-
医療機器目録(2023年8月17日付公告による一部調整)

Ⅲ. 輸入医療機器の届出・登録
中国に医療機器を初めて輸入する際には、製品のリスク分類(第I類・第II類・第III類)に応じて、国家薬品監督管理局(NMPA)に対して「届出(第I類)」または「登録申請(第II類・第III類)」を行う必要がありま 輸⼊医療機器には、中国語の取扱説明書と中国語のラベルを必ず貼付します。また、中国国外の医療機器⽣産企業は品質管理体系において、中国国内で販売、使⽤する医療機器が「医療機器説明書およびラベル管理規定」に適合することを保証する管理⼿続きを確⽴する必要があります。
外国の医療機器製造業者は、中国国内の企業法人を申請代理人として指定し、登録・届出手続きを代行させる義務があります。申請代理人は、NMPAとの連絡窓口として、申請資料の提出、登録証・備案証の取得、製品情報の更新などを担います。
申請時には、以下の資料を提出する必要があります:
- 製品リスク分析資料
- 製品技術要求(技術仕様書)
- 製品検査報告書
第I類:自主検査報告書(製造者自身による検査)
第II類・第III類:指定検査機関による検査報告書 - 臨床評価資料(第II類・第III類のみ)
- 製品取扱説明書およびラベル(中国語)
- 製品の研究・製造・品質管理体系文書
- 海外販売許可証(CE、FDA等)
中国国外で製造された医療機器を中国国内で販売・使用する場合、製品には必ず中国語による取扱説明書およびラベルを添付する必要があります。これらは、国家食品薬品監督管理総局令第6号《医疗器械说明书和标签管理规定》(2014年10月1日施行)に基づき、製品の登録申請時に提出する資料の一部として求められます。
説明書およびラベルには、製品の名称、型式、使用目的、使用方法、禁忌、注意事項、保管条件、製造業者および中国国内代理人の情報、登録証番号などが明記されていなければなりません。記載言語は簡体字中国語が原則であり、他言語を併記する場合でも中国語が優先されます。
これに伴い、中国国外の医療機器製造企業は、自社の品質管理体系において、中国市場向け製品がこの規定に適合することを保証する管理手続きを確立する必要があります。具体的には、製品設計・製造・出荷の各段階で、中国語の説明書・ラベルが正しく添付されるよう、社内の文書管理・検査・出荷確認プロセスに組み込むことが求められます。
この対応は、製品の登録申請時のみならず、登録後の変更申請や市場監督時にも重要な要素となるため、企業の品質保証部門と法規対応部門が連携して体制を整備することが不可欠です。
また、外国製造業者は、製品の販売後管理(苦情対応、不良事象報告、リコール、アフターサービスなど)を履行するために、中国国内に機関を設置するか、または相応の資格を持つ法人に委託する必要があります。申請代理人とアフターサービス委託先は、別法人であっても構いません。
アフターサービス委託先には、以下のような要件が求められます:
- 中国国内に登記された企業法人であること
- 医療機器の技術支援、苦情対応、リコール対応などを担う体制が整備されていること
- NMPAの監督下で、製品の安全性・有効性に関する責任を履行できること
なお、申請代理人には、品質管理体系の構築・運用に関する知識と経験を有する専任人員の配置が求められますが、上市後業務の実施責任は負いません。第I類医療機器の備案証の有効期限については法令上明示されていません。ただし、製品情報や技術要件に変更が生じた場合には、変更届出を行う必要があります。第II類・第III類医療機器の「医療機器登録証」の有効期限は5年であり、満了の6か月前までに更新申請が必要です。
登録手続き代理人、アフターサービス委託先以外の中国国内企業も、医療機器の輸入者として通関申請を行うことが可能です。 ただし、通関時には税関に対して、登録証(または備案証)の原本または写しを提示する必要があります。現在では電子データ連携制度により、登録情報は税関と国家薬監局間で照合される仕組みが整備されています。 一方、輸出側については、登録・届け出した国外製造者(登録人)は、医療機器の輸出業務を他の企業に委託することが制度上可能です。ただし、製品の品質、安全性、有効性に関する法的責任は登録人が負うことが求められています。
Ⅳ. 強制性認証(CCC)について
2013年4⽉26⽇の中国国家品質監督検査検疫総局、国家⾷品薬品監督管理総局、国家認証認可監督管理委員会の連名公告(2013年第52号)が公布され、現在、CCC認証を必要とする医療機器はありません。なお、2020年4月21日、国家市場監督管理総局より公布され、同日発効の新たな「強制製品認証実施製品⽬録」にも、医療機器は含まれていません。
Ⅴ. 機電製品輸入許可の取得
HS9018、9022に属する中古の医療機器は輸⼊禁⽌です(「機電製品輸⼊管理弁法」商務部、税関総署、国家品質監督検査検疫総局令2008年第7号、および「輸⼊禁⽌貨物⽬録」)。また、「自動輸入許可管理貨物目録」に記載のある⼀部の医療機器は、商務部または地⽅、関係機関の機電製品輸出輸⼊弁公室に「⾃動輸⼊許可」の申請・取得が必要です。
Ⅵ.オーダーメイド医療機器
「オーダーメイド医療機器監督管理規則(試行版)」は、2020年1月1日から施行されました。オーダーメイド医療機器とは、指定患者の希少で、特殊な傷病状況を満足させるために、医療機器メーカーが医療機関の特殊な臨床需要に基づいて設計し、生産される医療機器です。当該規定の施行によって、従来の標準規格に従って量産される医療機器以外に、海外医療機器メーカーが中国にオーダーメイド医療機器を輸出することができるようになりました。当該規定によると、オーダーメイド医療機器生産企業は、同じ種類の標準規格に基づいて量産される「医療機器登録証」および相応の生産許可証を持つ必要があります。(国外生産企業は、登録地もしくは生産地にある国または地域の医療機器主管部門が発行する企業資格証明書を持つ必要があります)。オーダーメイド医療機器については、登録する必要がなく、届出制度を実行し、輸入製品代理人が所在地の省、自治区、直轄市の薬品監督管理部門に届出をします。また、オーダーメイド医療機器が発売された後も、⽣産に関する品質管理体系、医療機器ラベル説明書、不良事件有害事象監視、製品のトレーサビリティなどの要求を遵守する必要があります。
Ⅶ.輸入医療機器の中国国内企業による生産
従来、輸入医療機器を中国国内で生産するには、国外登録者が製品および技術を中国国内企業に譲渡した後、国内企業が改めて製品の届出または登録申請を行う必要がありました。第I類医療機器および一部の臨床試験免除製品を除き、登録検査、臨床評価、申請資料のすべてを再度準備する必要があり、登録者にとっては同一製品に対する資料準備の重複が発生し、国産化の推進に対する障壁となっていました。
この課題に対応するため、国家薬品監督管理局は2020年9月18日に「輸入医療機器の中国国内企業による生産に関する公告」(第104号)を公布し、輸入医療機器の現地生産を促進する制度を導入しました。その後、2025年3月17日には「第30号公告」により制度が改正・拡充され、以下のような運用が確立されています。
- 対象製品と登録者の範囲の拡大
輸入医療機器登録証を取得済みの第II類・第III類医療機器および体外診断用医薬品について、国外登録者は以下のいずれかの形態で中国国内登録申請を行うことが可能です。- 登録者が中国国内に設立した外商投資企業
- 登録者と同一の実質的支配者を有する中国国内企業
これにより、技術移転の柔軟性が高まり、外資系企業による現地生産体制の構築が容易になりました。
- 登録申請資料の代替使用制度の正式導入
国内登録申請時には、製品の総括資料、非臨床資料、臨床評価資料について、既存の輸入医療機器登録申請資料を代替使用することが認められています。これにより、資料準備の重複が回避され、登録プロセスの迅速化が実現しています。 - 品質管理体系の同等性評価と誓約制度
国内登録者は、国外登録者の製品と同一の主要原材料・製造工程を維持することを誓約し、以下の資料を提出する必要があります。- 国内外の品質管理体系の同等性評価報告書
- 差異がある場合は、リスク分析報告書および管理策の提示
この制度により、品質の一貫性と安全性が確保されつつ、登録手続きの合理化が図られています。
- 実務運用との整合性
2025年現在、上海市など一部地域では、国家制度を補完する地方制度が導入されており、登録申請の審査期間短縮や優先審査制度の適用など、実務運用面でも制度の趣旨が反映されています。 - 制度の効果と企業への影響
これらの制度改正により、企業は以下のようなメリットを享受しています:- サプライチェーンの最適化(現地調達・製造の促進)
- 生産コストの低減(輸送費・関税の削減)
- 登録手続きの簡素化と期間短縮
- 中国市場への迅速な供給体制の構築
Ⅷ.その他の留意点
- 国家品質監督検査検疫総局によって、2007年6⽉に「輸⼊医療機器検査監督管理弁法」が公布されました。しかし、同管理弁法の施⾏予定⽇前⽇の同年11⽉30⽇に、国家品質監督検査検疫総局によって、管理弁法の施⾏を⾒合わせる公告が発表されました。同管理弁法は現在、施⾏⾒合わせの状態にあり、今後の動向に注意が必要です。
- 医療機器を日本から輸出する際の留意点
⽇本国内で流通している製品をそのまま輸出するのではなく、中国現地向け仕様に変更したもの(国内流通品の容器・外箱のデザインや表⽰語を現地向けに変更したものも含む)を輸出する場合、「輸出⽤医療機器製造・輸⼊届書」を厚⽣労働⼤⾂(届出窓⼝は独⽴⾏政法⼈医薬品医療機器総合機構)に提出し(提出数︓正本1、副本2、うち副本1通は返却される)、輸出通関の際には輸出通関書類にそのコピーを添付します。また、医療機器も安全保障貿易管理上のキャッチオール規制対象品であるため、輸出通関の際、安全保障貿易管理規制品に該当しないことを⾃⼰判定した該⾮判定書を提出する必要があります。⾃⼰判定の結果、安全保障貿易管理規制の対象になると思われる場合は、経済産業⼤⾂の輸出許可が必要です。
関係機関
関係法令
- 中国国務院
-
医療機器監督管理条例(国務院令第739号、改正公布2024年12月6日、施行2025年1月20日)

- 中国国家薬品監督管理局:
-
医療機器分類規則(国家薬品監督管理総局令第15号、2015年7月14日施行、2016年1月1日施行

-
医療機器分類目録の公布に関する公告(国家食品薬品監督管理総局公告2017年第104号、2017年8月31日公布、2018年8月1日施行)

-
「医療機器分類目録」の一部内容の調整に関する公告(国家薬監局公告2020年第147号、2020年12月18日公布・施行)

-
第I類医療機器製品目録の施行に関する通告(国家薬監局通告2021年第107号、2021年12月31日公布、2022年1月1日施行)

-
医療機器製品の分類判定業務の規範化に関する公告(国家薬監局公告2024年第59号、2024年5月10日公布、2024年9月1日施行)

-
医療機器説明書およびラベル管理規定(国家⾷品薬品監督管理総局令第6号、2014年10⽉1⽇施⾏)

-
国家食品薬品監督管理総局が輸入医療機器の登録申請者と届出者名称における中国語の使用に関する公告(2017年第131号、2017年10月31日公布、2019年1月1日施行)

-
オーダーメイド医療機器監督管理規定(試行)(国家薬監局公告2019年第53号、2019年6月26日公布、2020年1月1日施行)

-
『輸入医薬品通関証』など7種類の監督証明書に対するネットワーク照合の実施に関する公告(税関総署・国家薬品監督管理局公告2018年第148号)

-
国家医薬品監督管理局輸入医療機器の中国国内企業による生産に関する公告(国家薬監局公告2020年第104号、2020年9月18日公布、施行)

-
国家薬品監督管理局輸入医療機器製品の国内企業における製造に関する事項のさらなる調整と最適化についての公告(国家薬監局公告2025年第30号 2025年3月17日公布、施行)

-
上海市医薬品監督管理局医療機器登録証を取得した製品の上海市における製造への移行に関する手続きに関する規定を公布する旨の通知(沪薬監通告2025第22号、2025年8月14日公布、2025年10月1日実施)

-
国家薬品監督管理局 第1類医療機器の登録に関する事項に関する公告(2022年第62号、2022年8月11日施行)

-
「中華人民共和国医療機器管理法(案)意見募集稿」に関する意見の公募(2024年8月26日)

-
国家薬品監督管理局 医療機器登録品質管理システム審査ガイドラインの公表に関する通知 (2022年第50号、2022年09月29日公布)

- 国家行政サービスプラットフォーム | 国家医薬品監督管理局:
-
輸入第一類医療機器の登録

- 市場監督管理総局:
-
機医療機器登録・届出管理弁法(市場監管総局令第47号、公布日2021年3月18日、施行日2021年6月1日)

-
⼀部医療機器製品に対する強制的な製品認証管理を廃⽌する公告(中国国家品質監督検査検疫総局、国家⾷品薬品監督管理総局、国家認証認可監督管理委員会の連合公告2013年第52号、2013年4⽉26⽇施⾏)

- 商務部:
-
輸入禁止対象の旧機械電気製品目録の改正に関する事項の公布(商務部 海関総署公告2018年第106号、2018年12月26日公布)

-
「輸入許可証管理貨物目録(2025年)」(商務部公告第66号(2024年)、2024年12月31日公布)

調査時点:2014年10月
最終更新:2025年11月
記事番号: A-051123
ご質問・お問い合わせ
記載内容に関するお問い合わせ
貿易投資相談Q&Aの記載内容に関するお問い合わせは、オンラインまたはお電話でご相談を受け付けています。こちらのページをご覧ください。




 閉じる
閉じる
